ギモン雑学
1.顕熱と潜熱の違い
結論からいってしまうと顕熱(けんねつ)は”物質の温度変化に伴(ともな)う熱”、潜熱(せんねつ)は”物質の状態変化に伴う熱”です。

上図のように、”物質の温度を上げたり下げたりするときに伴う熱”を「顕熱(けんねつ)」、”水(液体)から水蒸気(気体)、水蒸気(気体)から水(液体)のように物質が状態変化するときに伴う熱(このとき物質の温度は変化しない)”を「潜熱(せんねつ)」と言います。
(物質が温度を上げるときや水から水蒸気に状態変化するときは”周囲から熱を奪い”、反対に物質が温度を下げるときや水蒸気から水に状態変化するときは”周囲に熱を放出”します)
では顕熱と潜熱について、それぞれ詳しく見ていきましょう。
顕熱(けんねつ)とは、”物質の温度変化に伴う熱”です。
![]()
顕熱は、”物質の温度を上げるときに(その物質が)周囲から奪う熱”と”物質の温度を下げるときに(その物質から)周囲に放出される熱”の両方を指します。
(”顕”という字には「はっきりとする。あきらかになる」の意味があり、物質の熱の増減によって目に見えて分かる温度変化があることから”顕熱”と名付けられています)
一般的に物質には”固体・液体・気体”の3つの状態がありますが、どの状態(固体・液体・気体)のときであっても温度変化に伴う熱(顕熱)の呼び方は同じです。
1[g]の水の温度を1[℃]上昇させるのには、約4.2[J](ジュール:熱量の単位)の熱(顕熱)が必要になります。

なので1[g]の水の温度を0[℃]から100[℃]まで上昇させるには、約420[J](ジュール:熱量の単位)の熱(顕熱)が必要になる、ということです。
(反対に1[g]の水の温度を100[℃]から0[℃]に下げるには、その水から約420[J]の熱(顕熱)を放出する必要がある、ということ)
潜熱(せんねつ)とは、”物質の状態変化に伴う熱(このとき物質の温度は変化しない)”です。
![]()
潜熱は、”物質の状態を変化させるときに(その物質が)周囲から奪う熱”と、”物質の状態を変化させるときに(その物質から)周囲に放出される熱”の両方を指します。
(”潜”という字には「もぐる。かくれる」の意味があり、物質の熱の増減によって温度変化しないので熱が隠れたように見えることから”潜熱”と名付けられています)
顕熱とは違って、潜熱にはそれぞれの状態変化の名称に応じた下図のような名称が付けられています。

上図のように状態変化のそれぞれの名称に応じて”融解潜熱(固体→液体)、凝固潜熱(液体→固体)、蒸発潜熱(液体→気体)、凝縮潜熱(気体→液体)、昇華潜熱(固体→気体、気体→固体)”と名付けられています。
ただ一般的にはそれぞれ”融解熱(融解潜熱)・凝固熱(凝固潜熱)・蒸発熱(蒸発潜熱)・凝縮熱(凝縮潜熱)・昇華熱(昇華潜熱)”と呼ばれることが多く、蒸発熱については”気化熱”と呼ばれることがほとんどです。
1[g]の水の温度を0[℃]から100[℃]まで上昇させるには、約420[J]の熱(顕熱)が必要になりますが、水を例にした状態変化ごとの潜熱については下図のようになります。

例えば上図のように、100[℃]の水を100[℃]の水蒸気に状態変化させるには、水1[g]当たり2257[J]の熱(蒸発潜熱=気化熱)が必要になります。
(0[℃]の水を1[g]蒸発させるためには2502[J]の熱が必要で、水の温度が低いほど蒸発させるためには多くの熱が必要になります)
0[℃]の水を1[g]蒸発させるために周囲から奪う2502[J]の熱というのは、100[g]の水の温度を約6[℃]変化させるほどの熱量です。
なので汗や水分が体に付着していると、水分は体から蒸発潜熱(気化熱)を奪っていって蒸発するので体がどんどん冷えていく、ということが分かります。
以上が「顕熱と潜熱の違いをわかりやすく図で解説!」でした。

上図のように、”物質の温度を上げたり下げたりするときに伴う熱”を「顕熱(けんねつ)」、”水(液体)から水蒸気(気体)、水蒸気(気体)から水(液体)のように物質が状態変化するときに伴う熱(このとき物質の温度は変化しない)”を「潜熱(せんねつ)」と言います。
(物質が温度を上げるときや水から水蒸気に状態変化するときは”周囲から熱を奪い”、反対に物質が温度を下げるときや水蒸気から水に状態変化するときは”周囲に熱を放出”します)
では顕熱と潜熱について、それぞれ詳しく見ていきましょう。
顕熱(けんねつ)とは
顕熱(けんねつ)とは、”物質の温度変化に伴う熱”です。
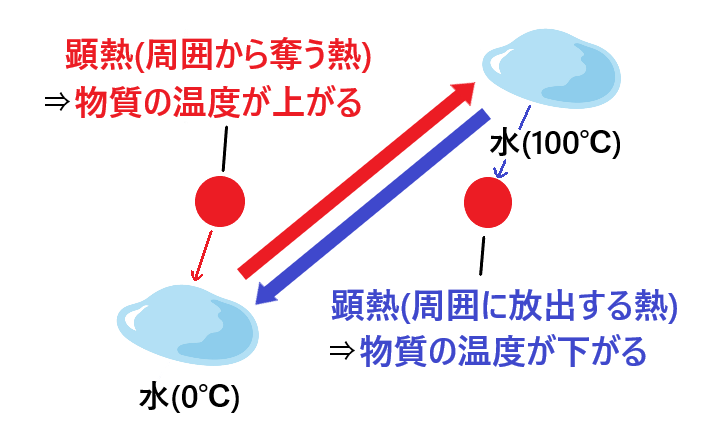
顕熱は、”物質の温度を上げるときに(その物質が)周囲から奪う熱”と”物質の温度を下げるときに(その物質から)周囲に放出される熱”の両方を指します。
(”顕”という字には「はっきりとする。あきらかになる」の意味があり、物質の熱の増減によって目に見えて分かる温度変化があることから”顕熱”と名付けられています)
一般的に物質には”固体・液体・気体”の3つの状態がありますが、どの状態(固体・液体・気体)のときであっても温度変化に伴う熱(顕熱)の呼び方は同じです。
1[g]の水の温度を1[℃]上昇させるのには、約4.2[J](ジュール:熱量の単位)の熱(顕熱)が必要になります。

なので1[g]の水の温度を0[℃]から100[℃]まで上昇させるには、約420[J](ジュール:熱量の単位)の熱(顕熱)が必要になる、ということです。
(反対に1[g]の水の温度を100[℃]から0[℃]に下げるには、その水から約420[J]の熱(顕熱)を放出する必要がある、ということ)
潜熱(せんねつ)とは
潜熱(せんねつ)とは、”物質の状態変化に伴う熱(このとき物質の温度は変化しない)”です。
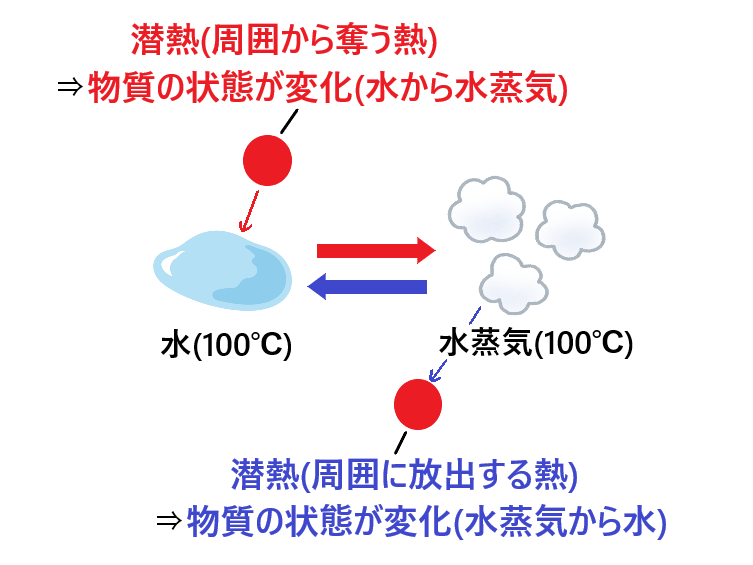
潜熱は、”物質の状態を変化させるときに(その物質が)周囲から奪う熱”と、”物質の状態を変化させるときに(その物質から)周囲に放出される熱”の両方を指します。
(”潜”という字には「もぐる。かくれる」の意味があり、物質の熱の増減によって温度変化しないので熱が隠れたように見えることから”潜熱”と名付けられています)
顕熱とは違って、潜熱にはそれぞれの状態変化の名称に応じた下図のような名称が付けられています。

上図のように状態変化のそれぞれの名称に応じて”融解潜熱(固体→液体)、凝固潜熱(液体→固体)、蒸発潜熱(液体→気体)、凝縮潜熱(気体→液体)、昇華潜熱(固体→気体、気体→固体)”と名付けられています。
ただ一般的にはそれぞれ”融解熱(融解潜熱)・凝固熱(凝固潜熱)・蒸発熱(蒸発潜熱)・凝縮熱(凝縮潜熱)・昇華熱(昇華潜熱)”と呼ばれることが多く、蒸発熱については”気化熱”と呼ばれることがほとんどです。
1[g]の水の温度を0[℃]から100[℃]まで上昇させるには、約420[J]の熱(顕熱)が必要になりますが、水を例にした状態変化ごとの潜熱については下図のようになります。

例えば上図のように、100[℃]の水を100[℃]の水蒸気に状態変化させるには、水1[g]当たり2257[J]の熱(蒸発潜熱=気化熱)が必要になります。
(0[℃]の水を1[g]蒸発させるためには2502[J]の熱が必要で、水の温度が低いほど蒸発させるためには多くの熱が必要になります)
0[℃]の水を1[g]蒸発させるために周囲から奪う2502[J]の熱というのは、100[g]の水の温度を約6[℃]変化させるほどの熱量です。
なので汗や水分が体に付着していると、水分は体から蒸発潜熱(気化熱)を奪っていって蒸発するので体がどんどん冷えていく、ということが分かります。
以上が「顕熱と潜熱の違いをわかりやすく図で解説!」でした。
2.まとめ
これまで説明したことをまとめますと、
- 顕熱(けんねつ)とは”物質の温度変化に伴う熱”で、物質の温度を上げるときに(その物質が)周囲から奪う熱と、物質の温度を下げるときに(その物質から)周囲に放出される熱の両方を指す。
- 潜熱(せんねつ)とは、”物質の状態変化に伴う熱”で、物質の状態を変化させるときに(その物質が)周囲から奪う熱と、物質の状態を変化させるときに(その物質から)周囲に放出される熱の両方を指す。
- 潜熱は、状態変化のそれぞれの名称に応じて”融解潜熱(固体→液体)、凝固潜熱(液体→固体)、蒸発潜熱(液体→気体)、凝縮潜熱(気体→液体)、昇華潜熱(固体→気体、気体→固体)”と名付けられている。
関連ページ
<覚えておきたい知識>
鉄火巻きの具材は?、クリスマス・イヴはいつ?など
哀悼、重複、出生、集荷など
(写真あり)カラーボックス、ACアダプターなど
(写真あり)メンマ、かんぴょう、マシュマロなど
(地図あり)軍艦島、淡路島、屋久島など
<豆知識>
(写真あり)カレーの容器、視力検査の器具など
<名前は知っているけどわからないもの>
(写真あり)アヒージョ、マリトッツォなど
(写真あり)磯(いそ)、沿道、郊外など
(写真あり)うなじ、くるぶし、土踏まずなど
<よく使う言葉>
慣習、準拠、言わずもがな、明文化など
慣習的、致命的、便宜的、作為的など
互換性、慢性、普遍性、必然性など
蛙化、明文化、マンネリ化、擬人化など

